Ofta hör vi om osmos i samband med någon ny teknik - vattenfiltrering och rening, till exempel. Annonserna får processen att låta som något nytt och imponerande; en säker självförtroendebooster.
Det inger verkligen vördnad, inte så mycket för processen utan på grund av resultaten. Det är dock inte någon ny upptäckt. Vår naturliga värld och till och med våra egna kroppar har upprätthållit sig själva genom osmos sedan tidernas begynnelse.
Några nyckelfakta om osmos är dessa:
- Osmos och diffusion har många likheter, osmos kännetecknas dock av en permeabel barriär.
- Osmos spelar en viktig roll i biologiska funktioner eftersom vatten äntrar och lämnar cellerna genom osmos.
- Det finns två huvudsakliga faktorer som påverkar osmos, koncentrationsgradienten och osmotiskt tryck.
- Osmos fyller en primär funktion, utjämning av lösta ämnen över en semipermeabel barriär.
Det är uppenbart att osmos är en viktig process inom alla vetenskaper och i synnerhet inom biologi. Så låt oss börja med en bred titt på osmos och begränsa vårt fokus till vad du behöver veta om osmos. Och avslutningsvis tydliggöra skillnaden mellan diffusion och osmos.
Behöver du fräscha upp minnet kring cellbiologins grunder? Ingen fara, vi har artiklar för det med!

Vad är osmos?
I allmänna termer är osmos handlingen att utjämna koncentrationerna av lösta ämnen på båda sidor av en semipermeabel barriär.
Om en sida har en hög koncentration av lösta ämnen måste det finnas mindre vatten närvarande. Om det på andra sidan den semipermeabla barriären finns en lägre koncentration av lösta ämnen - alltså en större potential för vatten, kommer vattenmolekyler att passera barriären för att göra koncentrationen av lösta ämnen lika på båda sidor.
Kom ihåg att osmos är en vanlig process inom tillverkning och andra aspekter av vårt dagliga liv. Det är också en ofta använd process i kemiska studier och tillämpningar. Ofta använder dessa osmotiska processer lösningsmedel och lösta ämnen - därav användningen av dessa ord i den allmänna beskrivningen ovan.
Med läxhjälp biologi får du ett studiestöd som dels förbättrar dina studieresultat. Men som också gör studierna mer strukturerade och lättbegripliga.

Inom biologi hänvisar osmos till nettorörelsen av vattenmolekyler genom cellmembran.
Vi kommer att fokusera på osmos inom biologi om en stund. Men för nu, låt oss fortsätta med vår allmänna översikt av osmos, nämligen ordförrådet som är specifikt för detta fenomen.
- Osmotiskt tryck: det minsta tryck som behövs för att förhindra inåtgående flöde över det semipermeabla membranet
- Osmotisk gradient: skillnaden mellan två lösningars koncentration över membranet
- Turgortryck: kraften som pressar plasmamembranet i cellen mot cellväggen
- Hypotonisk: cellen får vattenmolekyler
- Isotonisk: ingen nettorörelse av vatten över membranet
- Hypertonisk: cellen förlorar vattenmolekyler
- Plasmolyserad: cellens tillstånd när den är hyperton
- Slapp: cellens tillstånd när den är isoton
- Turgid: cellens tillstånd när den är hypoton
Nu när du fått bättre koll på ordförrådet. Och innan vi går vidare till strukturen av växt- och djurceller som tillåter osmos, låt oss titta på några faktorer som kan påverka processen.
Faktorer som påverkar osmos
Två huvudfaktorer påverkar den osmotiska processen: koncentrationsgradienten – även kallad osmotisk gradient, och osmotiskt tryck. Vi gav en kort definition av båda i föregående segment, låt oss nu prata om dem mer i detalj.
Koncentrationsgradient
Koncentrationsgradienten hänför sig till koncentrationen av partiklar lösta i en lösning; särskilt skillnaden mellan koncentrationsprocenten. Detta tillstånd föreligger när det finns en högre koncentration av lösta ämnen på ena sidan av ett semipermeabelt membran än på den andra.
Föreställ dig att du precis har tillsatt lite salt i ett glas vatten. Punkten där du införde saltet har en högre koncentrationsgradient än på andra ställen i vattnet och eftersom det sjunker till botten och ackumuleras, är det där koncentrationen är högst. När du sedan rör ner saltet i vattnet sprids dessa molekyler och till slut fördelar saltet jämnt i vattnet.
Vid den tidpunkten sägs lösningen ha nått jämvikt.
Celler använder koncentrationsgradienter för att flytta ett ämne in i eller ut ur sina celler. Den lagrade energin som är inneboende i koncentrationsgradienter används för detta ändamål.
Det kanske mest uppenbara exemplet på en sådan användning sker under en av våra mest vitala och grundläggande funktioner: andning. Visserligen är det ett exempel på gas som reflekterar en koncentrationsgradient men det kan fungera bra för att illustrera principen.
Syre följer reglerna för koncentrationsgradienter, precis som lösta ämnen gör. Det diffunderar också till områden med låg koncentration från områden med hög koncentration. Det är så, under deras lopp genom våra lungor, våra blodkroppar får syre.
Senare, när dessa celler går genom våra kroppar, förlorar de sitt syreinnehåll; diffunderar gasen återigen från ett område med hög koncentration (cellerna) till områden med låg koncentration - våra organ och vävnader.
Osmotiskt tryck
Enkelt uttryckt är osmotiskt tryck hur hårt vatten måste trycka för att ta sig igenom en semipermeabel barriär. Detta tryck bestäms av koncentrationen av löst ämne; vatten kommer att arbeta hårdare för att komma åt ett område med en högre koncentration av lösta ämnen.
Naturligtvis har vatten ingen oberoende vilja eller kunskap om lösta ämnens gradienter; den lyder bara naturlagarna som dikterar den slumpmässiga fördelningen av materien.
Ekvationen som används för att beräkna osmotiskt tryck är π = MRT
Ja, det är symbolen för Pi, men i denna ekvation representerar den inte det värdet. Det beslut antogs i samförstånd; kemister är alla överens om att det fungerar bra för att representera osmotiskt tryck. Att använda π, i det här fallet, är detsamma som att använda X i vilken annan algebraisk ekvation som helst.
På andra sidan likhetstecknet finner vi M (molar koncentration), R (idealgaskonstant) och T (temperatur [kelvin]). Du kanske inte behöver göra några osmotiska tryckberäkningar men du behöver minst ett exempel som perfekt illustrerar konceptet.
För det behöver vi veta lite om cellbiologi…


Osmos i biologin
Har du någonsin åkt på semester och, när du återvände, märkt att dina växter vissnade? Men sedan, efter att ha gett dem vatten, har de piggnat till igen… det är ett praktexempel på osmotiskt tryck.
Växter använder osmotiskt tryck för att behålla sin form; vattnet "blåser upp" cellerna och ger dem tillräckligt med utrymme för att fungera korrekt. En välvattnad växt med livfulla gröna blad och fylliga stjälkar isotoniska; en som håller på att vissna är hypertonisk - vattnet har flyttat ut ur cellerna och deras koncentration av lösta ämnen är nu för hög.
När du blir uttorkad genomgår cellerna i din kropp samma process: vattenmolekyler från muskler och andra organ överförs till dina blodkroppar via osmos eftersom de är hypertona. Det lämnar en hög koncentration av lösta ämnen i dessa celler, ett tillstånd som kan störa deras funktion.
Det skulle hjälpa att känna till cellstrukturernas funktion för att helt förstå processen, eller hur?
Till skillnad från generöst vattna växter kan vi inte bara hälla hinkar med vatten rätt ned i halsen och hoppas på omedelbara resultat; effekterna kan vara direkt farliga. Långsam rehydrering behövs för att ge våra celler tid att anpassa sig till osmotiskt tryck.
Osmoslaboration med potatis
Skivor (eller bitar) av potatis eller rödbetor i olika grader av salt eller sockervatten ger ett roligt experiment som visar effekterna av osmos. Prova denna osmoslaboration, du behöver bara vanlig potatis!
För det här experimentet behöver du flera provrör - ett med bara vatten och det andra med allt högre andel salt eller socker. Det vanliga vattenröret fungerar som en kontroll; de andra visar hastigheten på vattnet som rör sig ut ur skivorna eller bitarna.
Ju högre koncentration av salt eller socker, desto snabbare "töms" potatisbiten. Snart kommer du att se dina potatisarna krympa och efter att ha fiskat upp dem ur provrören och vägt dem kommer du att upptäcka att deras vikt också har minskat.
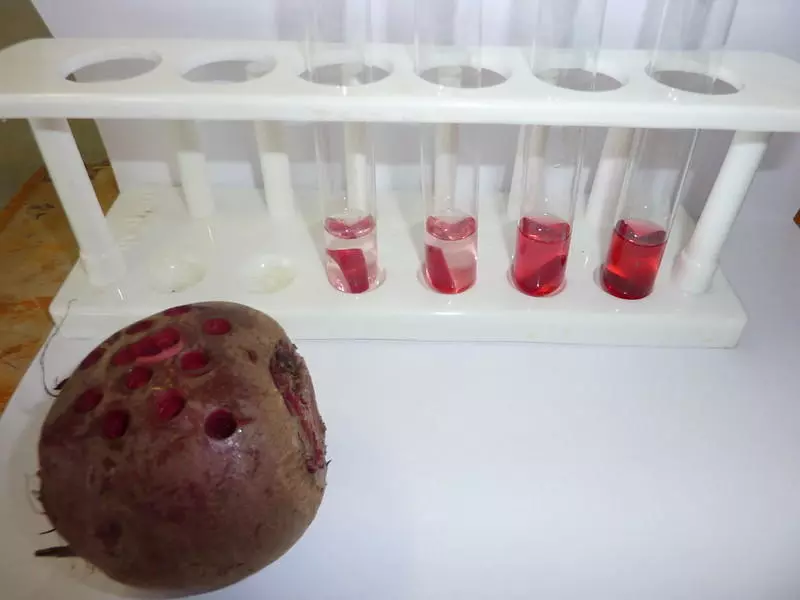
För att genomföra detta experiment måste du skära remsor från en potatis och torka av dem. Sätt upp dina provrör och notera koncentrationen av lösta ämnen i procent på vart och ett. Det är också en bra idé att förbereda en tabell för att registrera dina observationer.
Låt dina potatis- eller rödbetsremsor vila i sina lösningar i 20 minuter och dra sedan ut dem, torka av dem och kolla deras vikt. Vad var dina resultat?
Det räcker inte att göra endast ett test; för verkligt vetenskapliga resultat bör du upprepa experimentet för att se om du får ungefär samma resultat. Först då har du etablerat bevis på att vattnet i potatiscellerna har flyttat in i lösningen för att utjämna balansen av lösta ämnen.
Skillnad mellan diffusion och osmos
När du bläddrar igenom din biologilärobok, kanske du har märkt att "diffusion" och "osmos" då och då används synonymt. Om det får dig att klia dig i huvudet är du inte ensam: många förstår inte riktigt skillnaden mellan diffusion och osmos.
I princip representerar de samma sak: utjämning av koncentrationen av lösta ämnen. Men även om diffusion kan ske under alla förhållanden, sker osmos endast när det finns en semipermeabel barriär att passera.
Förutom närvaron av ett sådant membran är den största skillnaden mellan diffusion och osmos att i det senare passerar endast vatten membranet. Vid diffusion rör sig både det lösta ämnet och lösningsmedelspartiklarna för att utjämna koncentrationsgradienten.
Tänk på att osmos inom andra områden och andra vetenskaper sker med användning av andra lösta ämnen. Men inom biologin är det lösta ämnet i fråga bara vatten.
I alla fall kan osmos betraktas som en speciell typ av diffusion, en som kräver närvaron av ett semipermeabelt membran som endast det lösta ämnet kan passera.
Det finns mycket att lära sig när det kommer till diffusion: dess syfte och användbarhet i organismer, hur det fungerar i växter och djur, och vilka faktorer som påverkar diffusionen.
De är alla föremål för en annan artikel…
Sammanfatta med AI:















